โครงการประชุมวิชาการ เรื่อง Risk management plan (RMP): What, Why, and How?
มิถุนายน 7 - มิถุนายน 21

โครงการประชุมวิชาการ
เรื่อง Risk management plan (RMP): What, Why, and How?
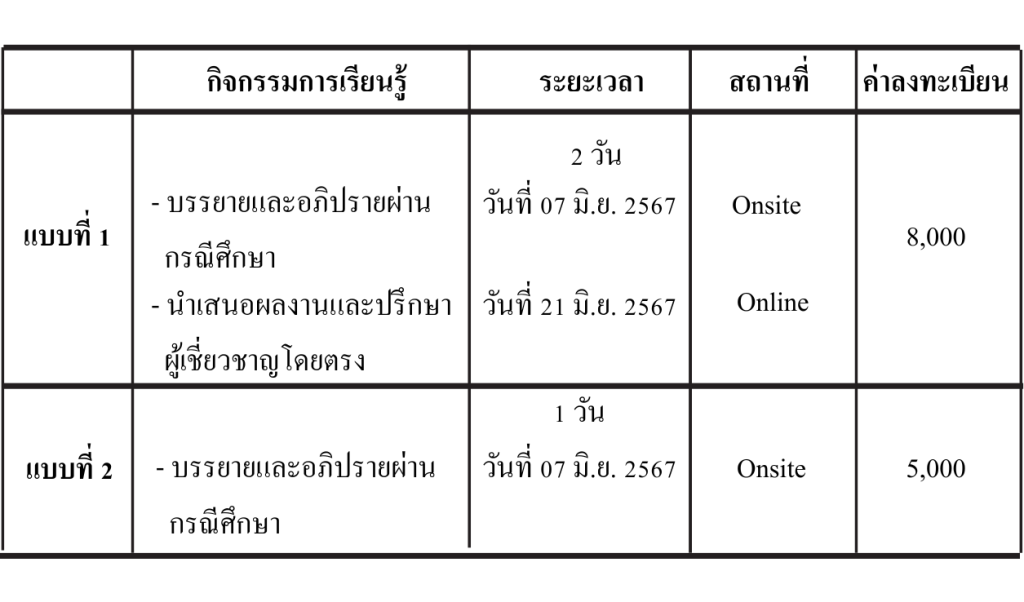
วันที่ 7 มิถุนายน 2567 onsite ณ คณะเภสัชศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย
และ วันที่ 21 มิถุนายน 2567 Online ทางระบบ Zoom meeting
CPE 4.50 Credits
หลักการและเหตุผล
ในการขอรับอนุมัติทะเบียนยาจากสำนักงานคณะกรรมการอาหารและยาจำเป็นต้องมีการศึกษาทดลองเพื่อยืนยันคุณภาพ ประสิทธิภาพ และความปลอดภัยของยา จึงต้องมีการศึกษาประสิทธิภาพและความปลอดภัยของยาในมนุษย์ก่อนจำหน่ายยาออกสู่ท้องตลาด อย่างไรก็ตาม การศึกษาประสิทธิภาพและความปลอดภัยของยาในมนุษย์มีข้อจำกัด เช่น จำนวนอาสาสมัครที่เข้าร่วมมีจำกัด รวมถึงอาสาสมัครบางกลุ่มไม่สามารถเข้าร่วมการศึกษาได้ ได้แก่ เด็ก สตรีมีครรภ์ ผู้สูงอายุ ผู้ที่มีความผิดปกติของตับหรือไต นอกจากนี้ ระยะเวลาการศึกษาวิจัยอาจไม่ยาวนานเพียงพอที่จะทำให้พบอาการไม่พึงประสงค์ที่เกิดจากยาที่ไม่ทราบมาก่อน (unexpected adverse drug reactions; unexpected ADRs) ซึ่งสำนักงานคณะกรรมการอาหารและยา ออกประกาศ แนวทางการพิจารณาทะเบียนตำรับยาแผนปัจจุบัน ที่ยื่นคำขอโดยวิธีทางอิเล็กทรอนิกส์ เมื่อเดือนมิถุนายน พ.ศ. 2566 ให้ผู้ประกอบการจัดเตรียม แผนจัดการความเสี่ยง (risk management plan, RMP) ในการขึ้นทะเบียนยา และรวมถึงการต่ออายุทะเบียนยา เพื่อใช้เป็นเครื่องมือสำหรับช่วยยืนยันว่าติดตาม หรือ ประเมินความเสี่ยง เปรียบเทียบกับประโยชน์ของยาที่ได้รับ รวมถึงเสนอกิจกรรมที่เหมาะสมเพื่อลดหรือควบคุมความเสี่ยงในผู้ป่วยที่ใช้ยา
ในการนี้ ภาควิชาเภสัชศาสตร์สังคมและบริหาร คณะเภสัชศาสตร์ เล็งเห็นถึงความสำคัญของหลักการพื้นฐาน ความเข้าใจ และการจัดเตรียม RMP จึงได้นำเสนอการจัดการอบรมวิชาการ โดยแบ่งเป็น 2 ส่วน โดยแต่ละส่วนใช้เวลา 1 วัน ทั้งนี้ในวันแรกจะครอบคลุมความรู้พื้นฐานที่เกี่ยวข้องกับ good pharmacovigilance practice และ RMP โดยจะครอบคลุมความรู้แนวลึกและการลงมือปฏิบัติจากกรณีศึกษา ในวันที่สองจะเป็นการนำเสนอและปรึกษาการจัดเตรียม RMP โดยจะเป็นลักษณะการปรึกษาในรูปแบบตัวต่อตัวกับคณาจารย์และผู้เชี่ยวชาญโดยตรง สำหรับการอบรมวิชาการนี้ มีคณาจารย์ ผู้เชี่ยวชาญเป็นวิทยากรการบรรยาย และการอภิปรายแลกเปลี่ยนความคิดเห็นเพื่อพัฒนา RMP ให้สอดคล้องเหมาะสมกับการยื่นประกอบการขอขึ้นทะเบียนตำรับยา
วัตถุประสงค์
- อธิบายความสำคัญและขอบเขต Pharmacovigilance (Good Pharmacovigilance practice) เบื้องต้น
- อธิบายขอบเขต Regulatory requirement for Pharmacovigilance of post-market phase
- อธิบายหลักการพื้นฐานของ RMP
- อธิบายขั้นตอนการเตรียม RMP
ผู้เข้าร่วมอบรม
- ผู้เข้าร่วมประชุมวันที่ 7 มิถุนายน 2567 จำนวน 100 ท่าน
- ผู้เข้าร่วมประชุมวันที่ 21 มิถุนายน 2567 จำนวน 60 ท่าน